
在過去的幾十年中,由於手術,放療和藥物治療的改善,提高了乳癌患者的存活率,延長壽命,因此,癌症治療後的長期生活逐漸開始被受重視,但治療後所造成的副作用卻深深影響患者的生活品質。而骨質疏鬆是乳癌患者最常發生的副作用之一。
什麼是骨質疏鬆?

骨質疏鬆(osteoporosis)是停經後婦女最常發生的健康問題之一。指骨骼內的骨質流失減少,骨質間產生空隙,使得原本密緻的骨骼漸漸地薄弱,導致骨組織的結構脆弱,而增加了骨折的機會,這種骨折最常發生於腰椎、股骨頭(大腿骨)及前臂的尺骨。
在健康女性中,峰值骨量發生在30歲左右,30歲以後,男女都會發生與年齡相關的骨質流失,中年以後骨質每年約減少0.3%~0.5%,停經後婦女流失速度更快。
骨頭的成分

為了保持結構的完整性,骨骼需要不斷地重塑和修復疏鬆的骨質,骨骼重塑過程由破骨細胞(osteoclasts,OCs),成骨細胞(osteoblasts,OBs)和骨細胞(osteocytes)所調控[1]。成骨細胞是骨形成的主要功能細胞,負責骨基質的合成、分泌和礦化,並分泌骨保護素(osteoprotegerin,OPG)也稱為破骨細胞形成抑制因子,亦是核因子κ-B配體受體致活劑(Receptor activator of nuclear factor kappa-B ligand,RANKL),當成骨細胞膜上的RANKL,活化了破骨細胞膜上的RANK蛋白,會加速破骨細胞破壞骨質並被吸收;而破骨細胞透過釋放乳酸、檸檬酸、碳酸、碳酸酐酶及溶酶體酶等,對骨組織進行分解破壞。成骨與破骨細胞分別負責維持骨形成和抑制骨重塑,其之間的平衡是維持正常骨量的關鍵,當平衡機制失控,則容易導致骨質流失,造成骨質疏鬆[2]。
乳癌患者骨質疏鬆的原因
同時增加骨保護素,可誘導破骨細胞的細胞凋亡,並增加維他命D及血鈣濃度,並增加骨密度減少骨折發生。研究發現,使用停經前婦女適用的卵巢切除及促性腺成長激素類似物(GnRH agonist),以及停經後適用芳香環轉化酶抑制劑(Aromatase inhibiter, AI)治療之乳癌患者,因透過減少體內雌激素對乳癌細胞的持續刺激進而抑制癌細胞的生長,但會降低雌激素在血液中的濃度並加速骨質流失,其骨質流失的量比停經婦女骨質流失高出兩到三倍,容易造成骨質疏鬆[3]。
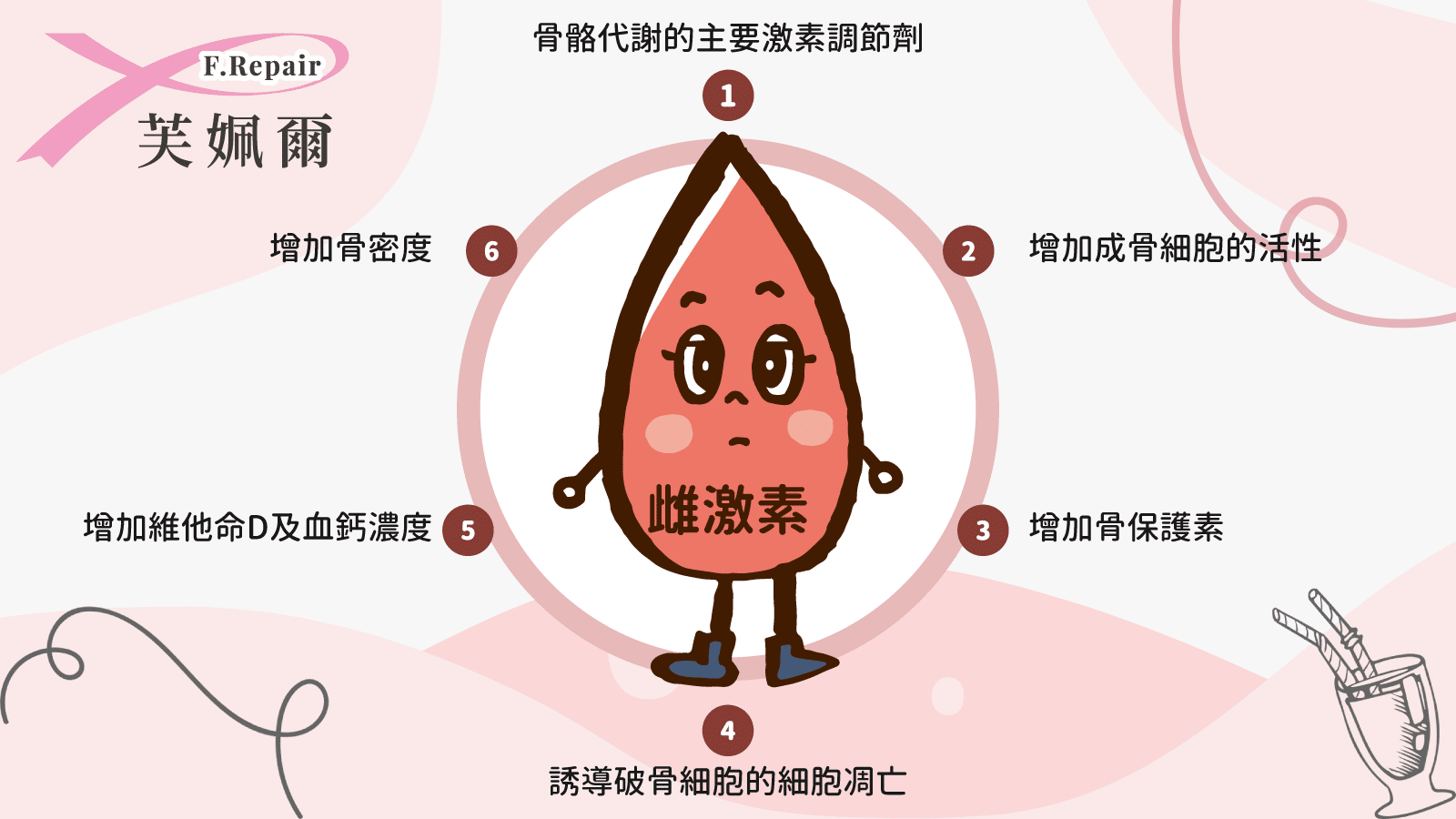
對一個健康女性而言,雌激素是維持骨骼強健的主要荷爾蒙。停經後婦女因為血中雌激素濃度的持續下降,因而導致了骨質流失。而罹患乳癌的患者而言,有許多的因素會導致骨質疏鬆發生的狀況比一般婦女來的早且來的嚴重。
為抑制癌細胞,使用藥物減少體內雌激素

化學治療造成的停經提早。
停經前乳癌婦女為了乳癌治療所做的卵巢切除。

停經前乳癌婦女使用GnRH相似物抑制卵巢功能。

停經後乳癌婦女使用芳香環酶抑制劑(復乳納、安美達及諾曼癌素等)。
為何荷爾蒙治療會導致骨質疏鬆
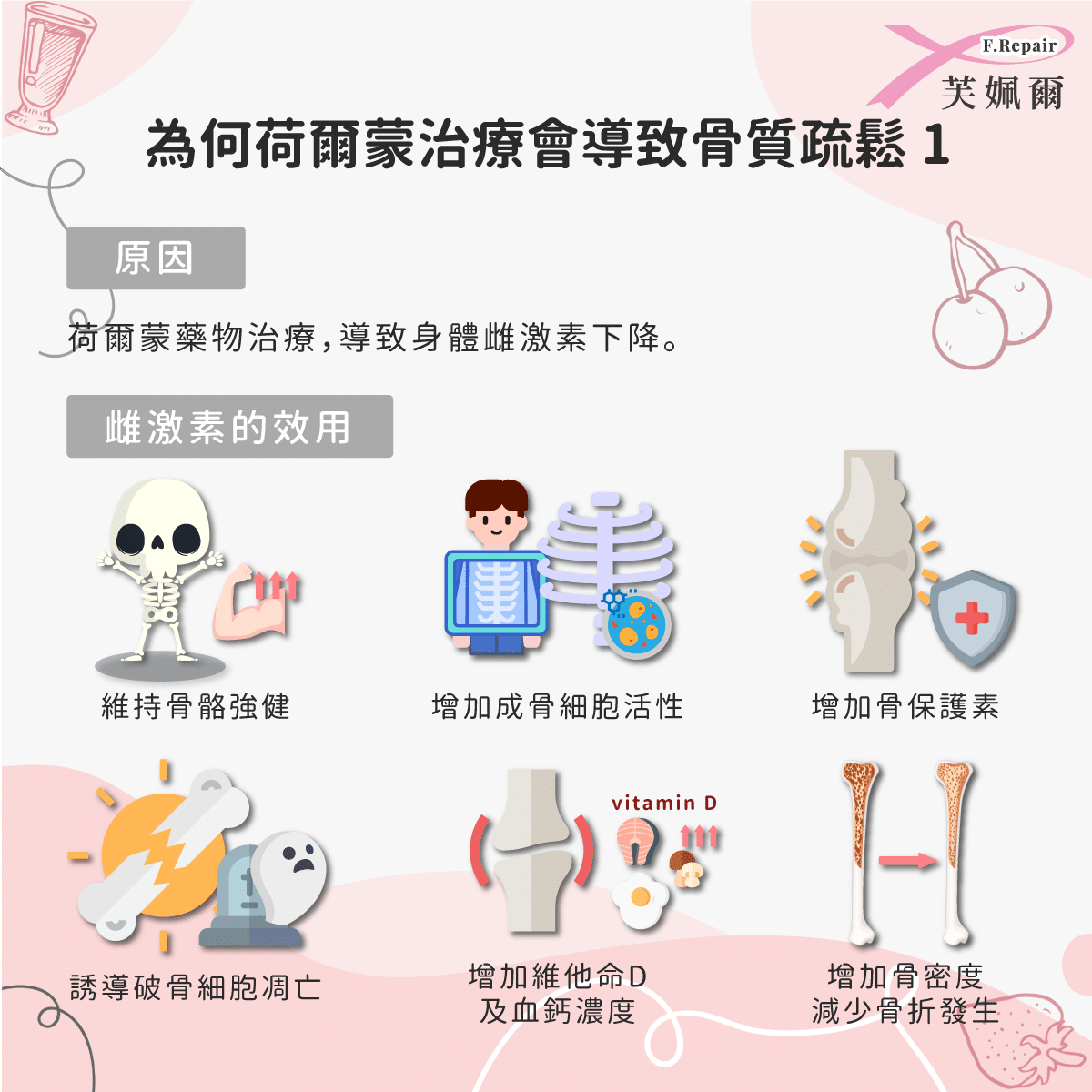

乳癌荷爾蒙治療策略之一,就是降低身體雌激素之生成,停經前之婦女會由腦部下視丘分泌性腺激素釋放素(LHRH)刺激腦下垂體分泌性線激素(LH和 FSH),再刺激卵巢而生成雌激素(estrogen),因此將雙側卵巢切除,或使用促性腺成長激素類似物(GnRH agonist)治療,使腦下垂腺體呈現衰竭狀況而無法進一步再分泌「性腺激素」,因此無法刺激卵巢合成雌激素,以達到療效,這些治療會抑制卵巢功能,長期下來會增加骨質流失、降低骨質密度造成骨質疏鬆。
芳香酶抑製劑(Aromatase inhibitor,AI),可以降低了腫瘤和血清中的雌激素濃度,是停經後雌激素接受體(Estrogen receptor, ER)呈陽性乳癌的婦女中被廣泛用作輔助治療的治療選擇。所有AI如:安美達(anastrozole)、復乳納(letrozole)或諾曼癌素(exemestane)都有相似的治療效果;與泰莫西芬相比,它們降低了局部,遠處復發,對側乳癌的風險,並改善了存活率,但它們也具有相同的副作用,包括有熱潮紅、膽固醇升高增加心血管疾病風險、肌肉關節痠痛、骨質流失、骨質疏鬆等,其流失的骨質足以導致骨質疏鬆並增加骨折的風險。隨著乳癌的死亡率的降低及存活時間的延長,更多的乳癌患者發生骨質疏鬆性骨折或跌落而導致骨折的風險提高[4, 5]。
癌症病人補鈣婦女骨質疏鬆症的危險因子女性骨質疏鬆原因
治療中應定期檢測骨質密度,並做好預防
骨質疏鬆症最常見的檢查是中央雙能X線骨密度儀(central dual-energy X-ray absorptiometry,DXA)掃描,測量整個脊柱、臀部和股骨頸的骨質密度,檢測的結果可用所謂的「T分數」(T-score)來表示,可預測骨折風險,世界衛生組織將正常T分數定義為-1.0或以上,將T評分在-1至-2.5之間的定義為骨質減少(osteopenia),將T評分低於-2.5義為骨質疏鬆症(osteoporosis),若骨質疏鬆(T分數≦-2.5)且合併骨折的發生,就可稱之為嚴重型骨質疏鬆[6, 7]。

荷爾蒙治療之乳癌患者骨質疏鬆治療方式
用於減輕在患者骨質疏鬆之情況,這些藥物的主要區別在於它們的作用機理,給藥途徑、毒性和成本不同。

藥物

日常飲食與運動
參考資料
放射線治療與玻尿酸有關係?專業知識讓專業的醫藥人員來說明!講到放射線治療,大家直覺印象就是皮膚反應──「臭火乾(操灰搭)」。要避免放療後的皮膚副作用,有兩個關鍵的保養步驟:1. 避免摩擦。2. 重視保濕。
許多女性乳癌患者在接受放射性治療後,發現經過放療的皮膚不僅膚色變深變黑,還容易紅腫發炎,一到換季更是有苦難言,搔癢、脫皮、濕疹等症狀輪番上陣,究竟是怎麼回事?
醫學科技的發達讓社會不再聞「癌」色變,透過藥物治療和放射性治療,早期癌症的治癒率高達八成以上。但是你知道經過放射線照射的皮膚很有可能被損傷,一旦錯過放療後的黃金治療修復期,甚至會造成影響終生的嚴重皮膚病嗎?